Vaccino per bimbi sotto i 5 anni, Pfizer chiede autorizzazione alla Fda
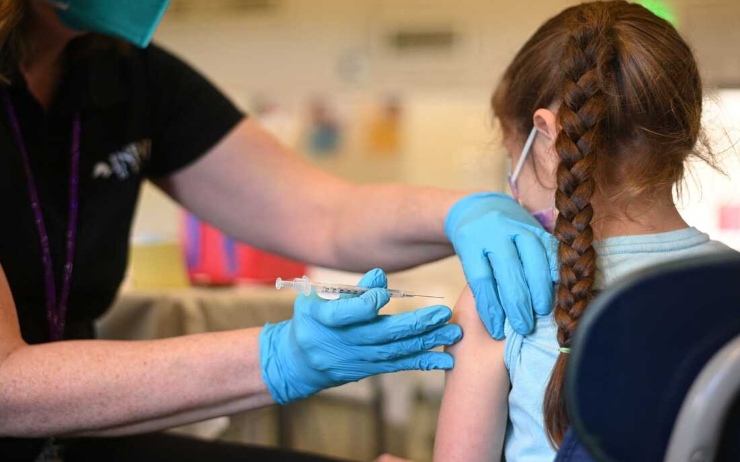
La casa farmaceutica annuncia di aver chiesto alla Food and Drug Administration l’approvazione per l’uso emergenziale.
Martedì Pfizer e BioNTech hanno chiesto alla Food and Drug Administration l’autorizzazione per la somministrazione di due dosi del loro vaccino anti-Covid ai bimbi della fascia di età dai sei mesi ai 4 anni. È una svolta importante arrivata nel momento in cui la pandemia preme sulle fasce di età più giovani. Se l’ente regolatorio statunitense darà la sua approvazione, il preparato potrebbe essere già somministrato, in Usa, entro la fine del mese di febbraio.
Per questa fascia di età verranno utilizzate due dosi, ciascuna delle quali equivalente a un decimo di quella impiegata per gli adulti, somministrate a distanza di 21 giorni l’una dall’altra (mentre per la fascia 5-11 anni si somministra un terzo della dose destinata agli adulti). I dati precisi non sono stati resi noti, ma lo studio Pfizer-BioNTech avrebbe mobilitato circa 1.200 bambini di età inferiore ai 2 anni e circa 1.500 di età compresa tra i 2 ei 4 anni.
Efficacia e sicurezza del vaccino
I risultati degli studi clinici avevano già evidenziato che il vaccino è sicuro e ben tollerato, anche se già a fine dicembre le aziende avevano comunicato che non si è giunti a risultati del tutto convincenti per quel che concerne l’efficacia. Dopo una bassa dose di vaccino Pfizer non sì è infatti prodotta – come invece ci si attendeva – un’importante risposta immunitaria nei bambini di età compresa tra i 2 e i 5 anni.
Negli studi clinici attualmente in corso le aziende hanno testato 3 microgrammi di vaccino a bambini fra i 6 mesi fino a poco meno di 5 anni. Stando a quanto riferito dalle società, dopo due dosi la risposta immunitaria dei bambini di età compresa tra 6 mesi e 2 anni è paragonabile a quella di individui di età compresa tra 16 e 25 anni. Ma non è accaduto lo stesso per i bambini tra i 2 ei 5 anni.
Nel tentativo di superare l’inatteso ostacolo dell’efficacia Pfizer e BioNTech si prefiggono ora di testare la terza dose di vaccino sui bambini tra i 6 mesi e i 5 anni (i risultati arriveranno tra circa due mesi), ma al momento non appaiono intenzionate a sperimentare una dose più alta nella fascia di età che ha fornito minor risposta al vaccino, cioè quella tra i 2 e i 5 anni. “L’obiettivo qui è capire il potenziale di protezione della terza dose, al momento stiamo studiando 3 microgrammi” ha fatto sapere la portavoce di Pfizer Jerica Pitts.
Fda ha pressato le aziende perché presentassero richiesta per uso emergenziale

Con una mossa inconsueta — afferma il New York Times — la Food and Drug Administration ha spinto le aziende a presentare richiesta di emergenza per il vaccino under 5 anche se le due dosi non hanno prodotto la risposta immunitaria auspicata. “Avere a disposizione un vaccino sicuro ed efficace per i bambini in questa fascia di età è una priorità per l’Agenzia e ci impegniamo in una revisione tempestiva dei dati che abbiamo chiesto a Pfizer alla luce del recente aumento della diffusione di Omicron” dichiara via twitter la dottoressa Janet Woodcock, commissario ad interim della FDA.
LEGGI ANCHE -> Sospendere la produzione di carne potrebbe salvare il pianeta: la ricerca
La richiesta di autorizzazione in via emergenziale è arrivata per il motivo che la variante Omicron, molto contagiosa, ha provocato a un picco record di contagi nel gruppo dei bimbi sotto i cinque anni, che comprende oltre 19 milioni di bambini statunitensi.
LEGGI ANCHE -> Bollettino coronavirus 2 febbraio: 118.994 contagi, 395 decessi
“I deludenti risultati della sperimentazione, annunciati a dicembre, hanno spinto le aziende a testare una terza dose del farmaco per quella fascia di età. Ma piuttosto che aspettare fino alla fine di marzo per i risultati, le autorità regolatorie federali hanno deciso di incoraggiare Pfizer a richiedere l’autorizzazione di un ciclo a due dosi adesso, nella speranza di ottenere comunque un vantaggio nello sforzo vaccinale volto a bloccare la pandemia” scrive il New York Times, secondo il quale alcuni funzionari federali sono convinti che se i bambini potranno ricevere una prima dose già a febbraio saranno pronti a ricevere la terza prima che i ricercatori riescano ad otterranno quelli che auspicabilmente saranno risultati ottimali della terza dose (la storia dei vaccini insegna che il richiamo rinforza la risposta immunitaria).
